干細胞治療老年糖尿病的五大機制發表時間:2021-02-04 18:08作者:杭吉干細胞科技 干細胞是一類具有高度增殖、多向分化、再生修復及自我更新特性的理想種子細胞。干細胞療法作為臨床治療某些難治性疾病的新型治療手段,表現出越來越重要的臨床價值和應用前景。 目前研究認為,干細胞在調控糖尿病患者胰島素分泌、糾正糖代謝紊亂、改善空腹血糖水平與餐后血糖及糖耐量值、控制或減輕糖尿病并發癥、延長糖尿病患者壽命、提高糖尿病患者生活質量等方面,發揮著極其獨特而重要的生物學作用。 老年糖尿病(EDM)是老年人隨著年齡不斷增長其衰老的生理性或病理性因素導致體內不能合成分泌或不能足夠合成分泌胰島素或無法有效使用胰島素而導致血液中葡糖糖水平升高時所引發的一種老年人慢性代謝性疾病。
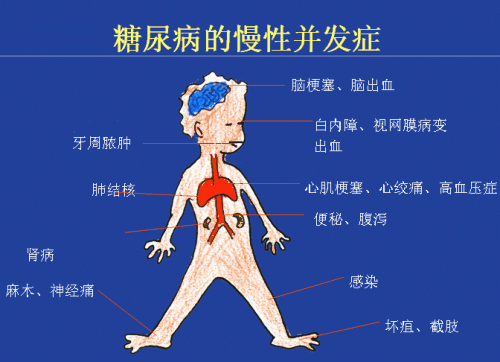
導致老年糖尿病的兩大因素EDM是由內源性遺傳和外源性環境因素共同作用所導致的一類以慢性糖代謝紊亂為主要特征和臨床表現的內分泌系統綜合征,也是老年人體內因胰島素缺乏或外周靶細胞無法對胰島素進行反應導致血糖水平較高或高血糖癥。 出現老年糖尿病誘發出現的并發癥如果長期不進行抑制,高血糖癥很容易誘導或促發人體各主要器官和組織的損傷,從而引起相應致殘和危害生命健康的多種并發癥,如糖尿病心血管疾病、糖尿病神經病變、糖尿病腎病變、糖尿病視網膜病變及眼部疾病、糖尿病足等。因此,控制EDM患者的血糖, 糾正EDM患者的糖代謝紊亂,可以有效延遲或預防糖尿病及其并發癥的進一步發生、發展。
現階段傳統療法治療老年糖尿病效果不佳目前,治療性胰島素及其他口服降血糖藥的應用是有效控制糖尿病患者血糖水平的方法之一,但長期胰島素和降糖藥物的使用均造成不同程度的副作用,且外源性胰島素仍不足以模擬內源性胰島素的天然活性,且具有低血糖的風險。此外,移植胰腺或胰島細胞卻因缺乏胰腺供體、胰腺細胞數量和活性、異體免疫排斥及手術和術后等諸多復雜性 因素影響而受到臨床應用的廣泛限制。 糖尿病的分類和診斷進展糖尿病(DM)的分類和診斷較為復雜,其中,包括那些60歲之前或者60歲之后明確診斷為糖尿病的患者。與其他糖尿病一樣,EDM也被認為是由內源性遺傳和外源性環境因素共同作用所導致的一類以慢性糖代謝紊亂為主要特征和臨床表現的內分泌系統綜合征,表現為老年人體內因胰島素缺乏或外周靶細胞無法對胰島素進行反應導致血糖水平較高或高血糖癥。所不同的是,EDM患者較一般成年糖尿病患者各組織器官結構衰退及功能減退更加明顯,甚至表現出一些不可逆改變。 干細胞治療糖尿病的主要機制原理體內誘導自體干細胞在糖尿病中的治療作用 糖尿病患者血清葡萄糖水平升高影響機體中性 粒細胞數量和功能。有研究顯示糖尿病大鼠外周血細胞計數、中性粒細胞吞噬指數降低。給予糖尿病大鼠粒細胞集落刺激因子(G-CSF),可以增加糖尿病大鼠成熟骨髓細胞數量。G-CSF可以作為糖尿病脂肪中成熟骨髓中性粒細胞的釋放因子,引起中性粒細胞增多,同時降低大鼠血糖。提示G-CSF可用于動員體內干細胞,改善糖尿病患者的非特異性免疫功能,降低血糖,起到治療糖尿病的作用。
臨床實驗表明受試者術前注射G-CSF,于第5d取出骨髓干細胞并植入肝臟,結果顯示,受試者胰島素分泌增加并降低受試者血糖。同時,發現骨髓間充質干細胞(BMSCs)逆轉了抗胰島抗體的產生和作用,并顯著增加了C肽濃度。值得注意的是,干細胞對糖尿病的治療作用并不局限于血糖的調控,還可改善糖尿病相關的并發癥。經患肢肌間分層注射自體外周血干細胞可改善T2DM患者的下肢血管 病變與糖尿病足,減輕患肢疼痛、冷感及間歇性跛行。 Lan等在體外誘導肌肉來源的干細胞分化為產生胰島素的胰島樣細胞,結果顯示胰島樣細胞移植有效地改善了糖尿 病小鼠的高血糖和糖耐量,提高了動物存活率。這些證據證明體外誘導干細胞分化為胰島樣細胞在體內外均具有胰島素產生能力,并具有治療糖尿病和控制血糖的潛力。 干細胞在糖尿病中的治療機制改善胰島β細胞功能機制:干細胞改善胰島β細胞功能,可能是其治療糖尿病的作用機制之一。目前認為,無論是T1DM還是T2DM,均是機體胰島β細胞功能紊亂或損傷,導致胰島素分泌不足而引起糖尿病的發病和加重。干細胞移植體內后,可特異性趨化并遷移至受損的胰島或通過分泌細胞因子促進受損胰島內β細胞的增殖,以修復和再生胰島β細胞,并可抑制β細胞凋亡。同時,它還可直接分化為胰島素分泌細胞或促進導管細胞、胰島祖細胞分化為胰島素分泌細胞。 抗炎及免疫調控機制:機體免疫失衡是糖尿病致病機制的關鍵因素之 一。通常,糖尿病的炎癥環境下,免疫細胞大量浸潤胰島組織,可加速破壞胰島β細胞,從而導致 機體胰島 β細胞數量減少,胰島素分泌不足,從 而誘發或加重糖尿病。因此,通過干細胞及時而有 效地改善機體微環境、調節免疫反應,是糖尿病治療的重要方向和策略之一。 有研究顯示,在T1DM、T2DM發生發展中,巨噬細胞浸潤到白色脂肪組織后,促進白細胞介素6 (IL-6) 和腫瘤壞死因子α (TNF-α)等促炎性細胞因子的釋放,引起長期慢性炎癥。長期慢性炎癥狀態也正是T2DM患者出現 胰島素抵抗的重要機制之一。 改善外周靶組織的胰島素抵抗機制:在T1DM的發病機制中,胰島素抵抗是很重要的原因之一。在胰島素靶組織上葡萄糖轉運蛋白4(GLUT4)表達下降,胰島素受體底物(IRSs)和絲氨酸/蘇氨酸蛋白激酶AKT的磷酸化發生紊亂,從而 影響胰島素信號的轉導及其作用發揮,而導致糖尿病療效降低、病情加重。而移植該干細胞后,可能通過上調胰島素靶組織中GLUT4的表達水平,影響GLUT4的位移和上調IRS-1和AKT的磷酸化 改善胰島素抵抗,進而改善高血糖癥狀。 調控血管生成機制:糖尿病患者常合并微血管和大血管損傷,繼而引起相應組織及器官的DM相關并發癥,常見的如糖尿病腎病、糖尿病足、糖尿病心肌病變等。值得注意的是,干細胞移植可能通過調控血管的生成, 促進組織修復,改善糖尿病并發癥。 進一步研究提示,IPS細胞通過激活內源性C-kit祖細胞向血管平滑肌和內皮細胞分化,從而增強新血管形成。 調節自噬相關機制:自噬是維持細胞內穩態的重要調控途徑,通過影響胞內物質降解而維持細胞正常功能。糖尿病后自噬相關機制的失調可導致胰腺β細胞數量減少及功能失常,從而引起胰島素分泌減少。已有研究表明,骨髓MSCs通過上調自噬相關蛋白Bec-lin1和LC3-Ⅱ的表達增強自噬,進而減輕長期高糖處理對大鼠胰島素瘤細胞(INS-1)的毒性作用,恢復INS-1細胞的基礎胰島素分泌及葡萄糖刺激的胰島素分泌。
小結干細胞移植對糖尿病的治療潛能已在體內外實驗得到證實。干細胞治療糖尿病不僅能通過改善胰島β細胞功能,調控免疫機制,改善胰島素抵抗及胰島素分泌,還通過調控新生血管的形成,進而使糖尿病微環境得以改善,從而達到治療糖尿病及相關并發癥。盡管干細胞在糖尿病中具有巨大的治療價值和應用前景。 |
行業動態 干細胞治療 干細胞移植 |