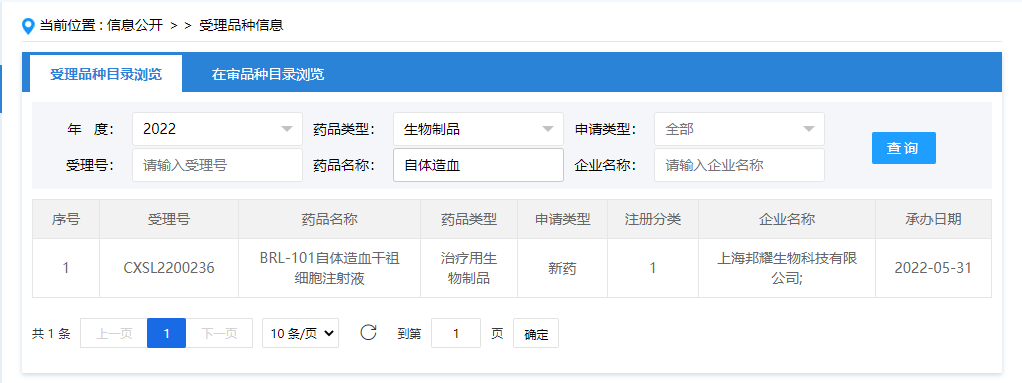
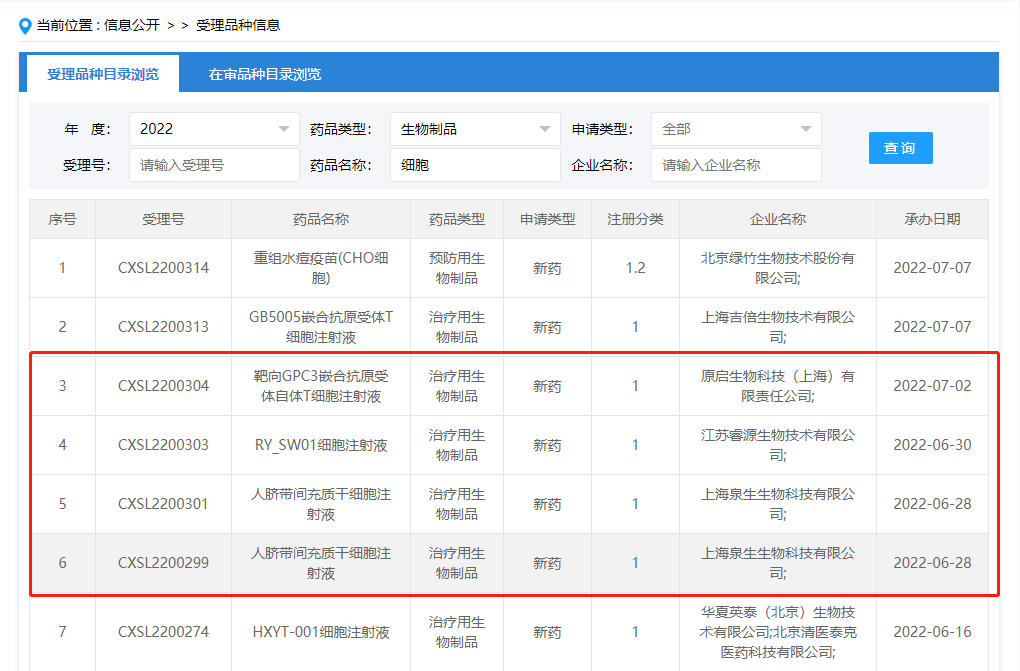
中國干細胞藥物注冊申報進展(5.31-6.30)發表時間:2022-07-07 17:05 2022年5月31日至6月30日,國內新增3家企業的4款干細胞藥物臨床試驗申請獲得受理;新增3款已獲得受理的干細胞藥物通過默示許可。 截至2022年6月30日,國內共有31家企業的42款干細胞藥物臨床試驗申請獲得受理,共有24家企業的33款獲準默許進入臨床試驗(IND申請通過默示許可)。 其中上海共有10家企業的15款干細胞藥物臨床試驗申請獲得受理,7家企業的11款干細胞藥物IND申請通過默示許可,是全國干細胞藥物研發最活躍的地區。 其次是北京有6家企業的7款干細胞藥物IND申請通過默示許可,天津有3家企業的5款干細胞藥物臨床試驗申請獲得受理(其中4款IND申請通過默示許可),江蘇有4家企業的5款干細胞藥物臨床試驗申請獲得受理(其中3款IND申請通過默示許可)。 9款未獲得默示許可的干細胞藥物中有3款無法查到IND評審信息,1款暫停,5款正在評審中。 新增受理:2022年5月31日,上海邦耀生物科技有限公司“BRL-101自體造血干祖細胞注射液”的藥物臨床試驗申請獲受理(受理號:CXSL2200236)。 2022年6月28日,上海泉生生物科技有限公司“人臍帶間充質干細胞注射液”的藥物臨床試驗申請獲受理(受理號:CXSL2200299/CXSL220031) 2022年6月30日,江蘇睿源生物技術有限公司“RYSW01細胞注射液”的藥物臨床試驗申請獲受理(受理號:CXSL22000303)。
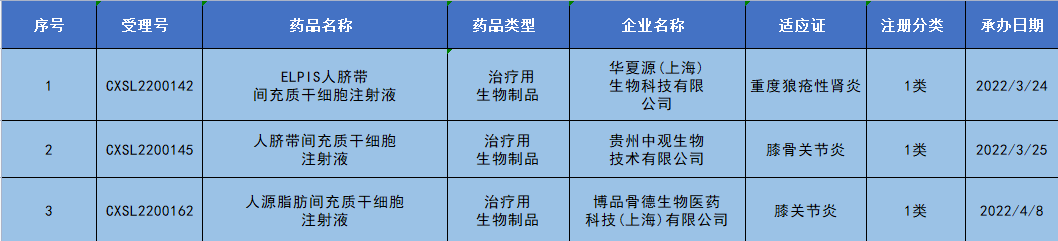
(圖片來源:CDE官網) 新增藥物臨床試驗通過默示許可:
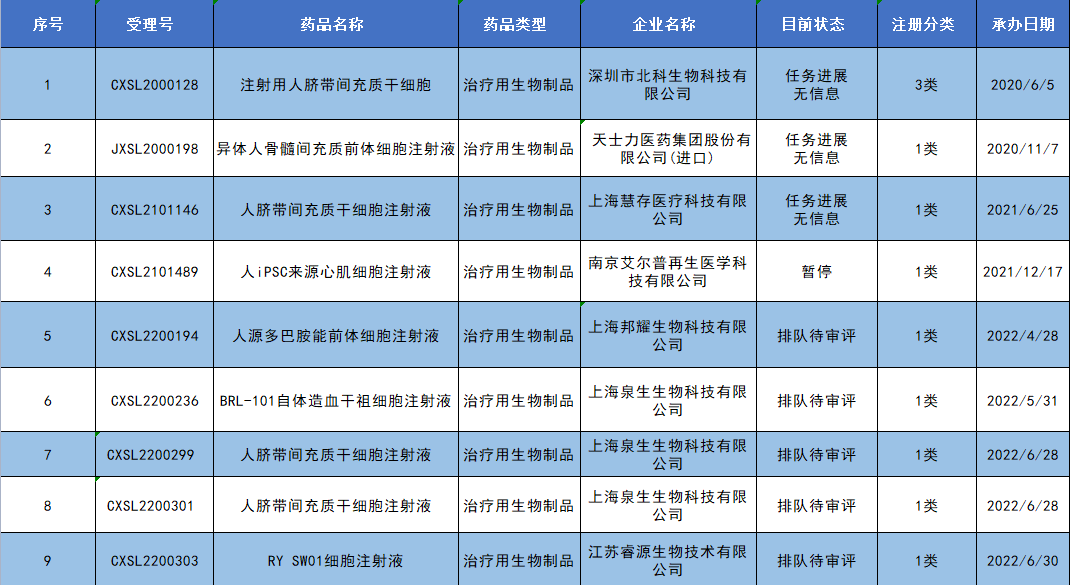
尚未通過臨床試驗默示許可的9款干細胞藥物狀態:
|
行業動態 干細胞治療 干細胞移植 |