IND獲批!我國干細胞藥品臨床試驗默示許可新增至26個發表時間:2022-02-16 14:51作者:杭吉干細胞科技
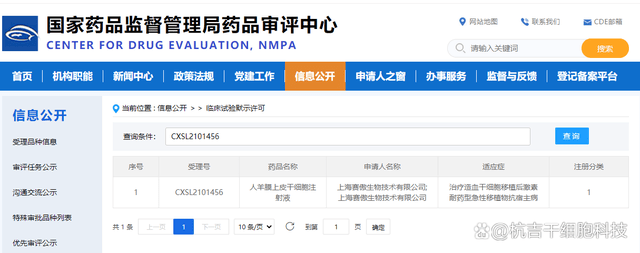
2月11日,國家藥品監督管理局藥品審評中心(CDE)正式審批通過上海賽傲生物技術有限公司提報的1類新藥臨床試驗“人羊膜上皮干細胞注射液治療造血干細胞移植后激素耐藥型急性移植物抗宿主病”申請。 截止2022年2月15日,我國已經通過IND的干細胞藥品,已達26個。
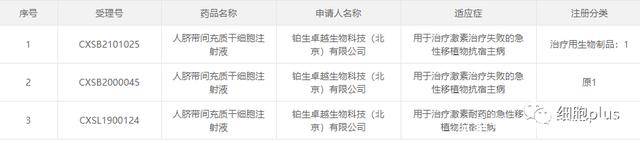
主要細胞種類是不同來源的間充質干細胞,個別是造血干祖細胞。 涉及病種包括膝關節炎、潰瘍性結腸炎(克羅恩病)、GVHD、特發性肺纖維化、銀屑病、ARDS、肝衰、地貧、牙周炎、腦卒中、糖尿病足等。 需要說明的是,其中鉑生卓越生物科技有限公司申報的從藥品名稱到適應癥都相同,但是分成了三個分類號,并歸類到了三個不同的注冊分類去,我們還是根據受理號算作三個不同的IND的藥品。
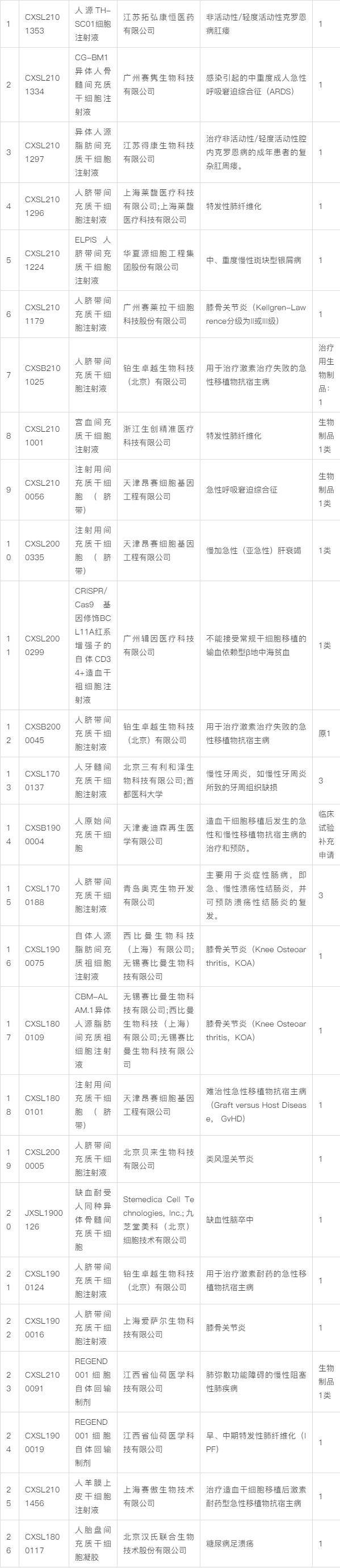
下面是所有通過國家藥監局藥品審評中心臨床試驗默示許可的干細胞藥品列表:
|
行業動態 干細胞治療 干細胞移植 |