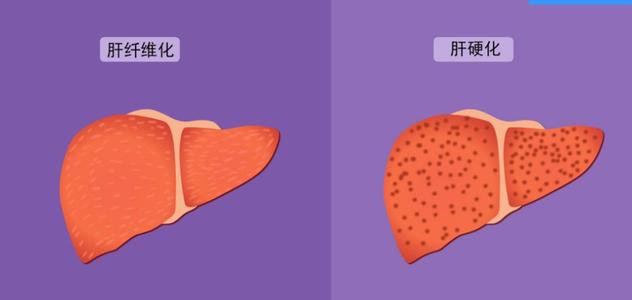
干細胞移植治療肝纖維化,主要是抑制肝星狀細胞凋亡發表時間:2021-04-07 16:41作者:中科干細胞 肝纖維化是各種慢性肝損傷,如病毒性肝炎、酒精、藥物、代謝性疾病和肝細胞自身免疫調節失調等原因導致的以肝組織中細胞外基質過度沉積為特點的慢性病理過程。
最近研究表明肝纖維化過程是可逆的。間充質干細胞(MSCs)是一類具有持續自我更新、增殖、多向分化和免疫調節活性的成體干細胞,MSCs通過肝源性分化、與肝細胞融合、旁分泌效應和免疫調節,直接或間接消除細胞外基質的沉積,有助于瘢痕組織的降解和促進肌成纖維細胞凋亡,成為治療肝纖維化最具潛力的種子細胞。
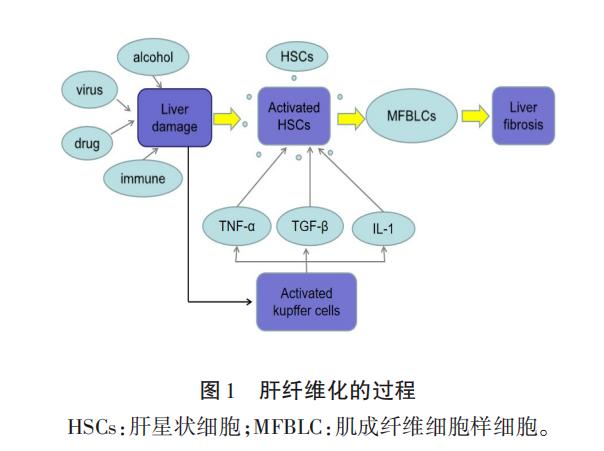
干細胞移植抑制肝星狀細胞凋亡越來越多的研究表明HSCs是合成和分泌細胞外基質成分的主要細胞,在肝纖維化中起關鍵作用。HSCs的活化是肝纖維化的重要因素。轉化生長因子-β是肝纖維化的關鍵介質,它觸發HSCs的激活,誘導細胞外基質合成,增加肝細胞凋亡。 研究發現多種細胞因子包括轉化生長因子-β(TGF-β)、血小板衍生生長因子(PDGF)、結締組織生長因子(CTGF)、成纖維細胞生長因子(FGF)、干擾素和瘦素,同時分泌大量的炎性因子如TNF-α、TGF-β-IL-1,激活鄰近的HSCs,促進HF(圖1)。
大量基礎實驗探究干細胞移植治療肝纖維化的機制骨髓間充質干細胞修復肝纖維化的機制 JANG等通過對BMSCs和HSCs體外直接共同培養,發現α-SMA極度下降, HSCs活性大幅降低,證明BMSCs自分泌可誘導HSCs凋亡,降低HSCs活化的準確性;通過 BMSCs和HSCs體內間接共同培養模擬旁分泌,導致可刺 激 HSCs 活化的TGF-β1、IL-6 減少,抑制HSCs活化 的肝細胞生長因子(HGF)、IL-10 增加,證明 BMSCs 可通過旁分泌來抑制 HSCs的活性。
臍帶間充質干細胞修復肝纖維化的機制 趙軍等人UC-MSCs在CCl4誘導的小鼠肝纖維化模型中的抗纖維化潛力,UC-MSCs可以運送GPX1,通過降解CCl4和H2O2,減少肝細胞的氧化應激和凋亡,從而發揮肝細胞保護作用(表1)。
UC-MSCs干預組大鼠血清ALT、AST、丙二醛、羥脯氨酸、層粘連蛋白、TGF-β1和INF-α水平明顯降低,反之谷胱甘肽水平顯著升高,提示UC-MCSCs可能通過減少氧化應激和炎癥介質進而減輕肝纖維化。 基礎研究目的:探討骨髓間質干細胞移植后肝星狀細胞凋亡情況及其治療肝纖維化的機制. 方法:實驗中心提供的30只清潔級SD大鼠,實驗研究20只,提取骨髓間質干細胞10只作為實驗組,建立肝纖維化大鼠模型,骨髓干細胞動員干預大鼠肝纖維化及肝星狀細胞凋亡,檢測肝纖維化及星狀細胞凋亡指標;將未提取骨髓間質干細胞的10只作為對照組,并對兩組大鼠的肝臟羥脯氨酸含量、肝星狀細胞激活及凋亡情況進行統計分析. 結果: CD34、CD44、CD45、CD95陰性細胞分別為99.75%、99.51%、99.80%、95.72%.CC]4皮下注射誘導8周后實驗組大鼠的肝臟羥脯氨酸含量顯著高于骨髓間質干細胞移植前(P<0.05); 實驗組大鼠骨髓間質干細胞移植1周后的肝星狀陽性細胞數顯著少于骨髓間質干細胞移植3d后(P<0.05); 骨髓間質干細胞移植1周后實驗組大鼠的肝星狀陽性細胞數顯著少于對照組(P<0.05). 骨髓間質干細胞移植3d后實驗組大鼠的肝星狀凋亡細胞數顯著多于骨髓間質干細胞移植前、對照組(P<0.05)。 結論: 骨髓間質干細胞移植后誘導肝星狀細胞凋亡可能是其治療肝纖維化的一個主要機制。
臨床案例目的:分析人臍帶間充質干細胞輔助治療對乙肝肝硬化患者肝功能、纖維化指標及炎癥程度的影響. 方法:選取經本院診治的乙肝肝硬化患者80例納入研究,按照接受治療方式不同,所有納入對象被分為觀察組及對照組各40例。對照組接受常規治療,觀察組接受人臍帶間充質干細胞輔助治療,對比兩組肝功能指標、肝纖維化指標、炎癥相關指標、病情相關指標水平差異。 結果:觀察組治療后血清ALB、GLB、A/G值高于對照組,α2-M、TB、APO-A1、GGT值低于對照組。 觀察組治療后血清HA、LN、CIV、PⅢNP、PLD值均低于對照組。 觀察組治療后血清TGF-p1、PCT、WBC、SIL-2R水平值均低于對照組。 觀察組經治療后血清FT3、ADP值高于對照組,NO、EGF、ADM、IR值低于對照組。 結論:乙肝肝硬化患者接受人臍帶間充質干細胞輔助治療,可以優化肝功能并抑制病情進展,具有積極的臨床意義。 |
行業動態 干細胞治療 干細胞移植 |